புரோட்டான்கள், எலக்ட்ரான்கள் மற்றும் நியூட்ரான்களின் எண்ணிக்கையை எவ்வாறு கண்டுபிடிப்பது
நூலாசிரியர்:
Roger Morrison
உருவாக்கிய தேதி:
27 செப்டம்பர் 2021
புதுப்பிப்பு தேதி:
1 ஜூலை 2024

உள்ளடக்கம்
- நிலைகளில்
- பகுதி 1 புரோட்டான்கள், எலக்ட்ரான்கள் மற்றும் நியூட்ரான்களின் எண்ணிக்கையைக் கணக்கிடுங்கள்
- பகுதி 2 ஒரு அயனியில் உள்ள எலக்ட்ரான்களின் எண்ணிக்கையைக் கணக்கிடுங்கள்
நியூட்ரான்கள், எலக்ட்ரான்கள் மற்றும் புரோட்டான்கள் ஒரு அணுவை உருவாக்கும் மூன்று முக்கிய துகள்கள். நீங்கள் யூகிக்கிறபடி, புரோட்டான்கள் நேர்மறையான கட்டணத்தைக் கொண்டுள்ளன, எலக்ட்ரான்கள் எதிர்மறை கட்டணத்தைக் கொண்டுள்ளன, மேலும் நியூட்ரான்கள் நடுநிலை துகள்கள் மட்டுமே. எலக்ட்ரான்களின் நிறை மிகவும் சிறியது. இருப்பினும், நியூட்ரான்கள் மற்றும் புரோட்டான்கள் ஒத்த வெகுஜனங்களைக் கொண்டுள்ளன. ஒரு அணுவின் புரோட்டான்கள், எலக்ட்ரான்கள் மற்றும் நியூட்ரான்களின் எண்ணிக்கையைக் கண்டுபிடிக்க, மெண்டலீவின் அட்டவணை என்றும் அழைக்கப்படும் தனிமங்களின் கால அட்டவணையைப் பார்ப்பது போதுமானது.
நிலைகளில்
பகுதி 1 புரோட்டான்கள், எலக்ட்ரான்கள் மற்றும் நியூட்ரான்களின் எண்ணிக்கையைக் கணக்கிடுங்கள்
-
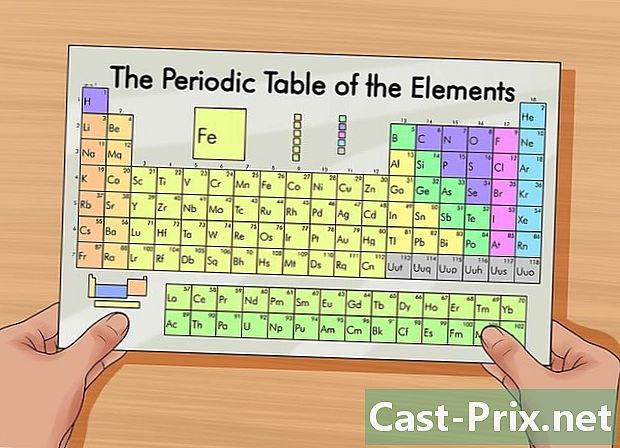
குறிப்பிட்ட கால அட்டவணையைப் பெறுங்கள். ஒரு உறுப்பில் உள்ள புரோட்டான்கள், எலக்ட்ரான்கள் மற்றும் நியூட்ரான்களின் எண்ணிக்கையைக் கண்டறிய இந்த அட்டவணை உங்களுக்கு உதவும். உறுப்புகளை அவற்றின் அணு கட்டமைப்பிற்கு ஏற்ப முன்வைக்கும் அட்டவணை இது. ஒரு வண்ண குறியீடு வெவ்வேறு கூறுகளை வேறுபடுத்துகிறது. ஒவ்வொரு உறுப்பு ஒன்று, இரண்டு அல்லது மூன்று எழுத்துக்களைக் கொண்ட ஒரு குறியீட்டால் அடையாளம் காணப்படுகிறது. ஒவ்வொரு உறுப்பின் அணு நிறை மற்றும் அணு எண் போன்ற பிற தகவல்களையும் அட்டவணை காட்டுகிறது.- இணையத்தில் அல்லது வேதியியல் புத்தகத்தில் ஒரு தேடலைச் செய்வதன் மூலம் இந்த விளக்கப்படத்தை நீங்கள் காணலாம்.
- தேர்வுகளில், நீங்கள் வழக்கமாக உறுப்புகளின் கால அட்டவணையைப் பயன்படுத்த அனுமதிக்கப்படுவீர்கள்.
-
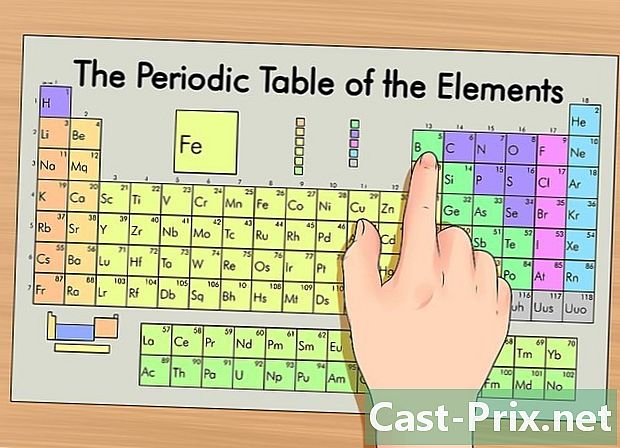
கால அட்டவணையில் உங்கள் உறுப்பை அடையாளம் காணவும். அட்டவணையில், உறுப்புகள் அவற்றின் அணு எண்ணுக்கு ஏற்ப தொகுக்கப்படுகின்றன. அவை மூன்று முக்கிய குழுக்களாக பிரிக்கப்பட்டுள்ளன: உலோகங்கள், அல்லாத பொருட்கள் மற்றும் மெட்டல்லாய்டுகள் (அரை உலோகங்கள்). மற்ற குழுக்களில் கார உலோகங்கள், ஆலசன் மற்றும் உன்னத வாயுக்கள் அடங்கும்.- வரிசையில் ஒரு உறுப்பை அதன் குழு (நெடுவரிசை) அல்லது காலம் (வரிசை) பயன்படுத்தி கண்டறிவது எளிது.
- தனிமத்தின் பண்புகள் உங்களுக்குத் தெரியாவிட்டால், அதன் குறியீட்டைத் தேடலாம்.
-
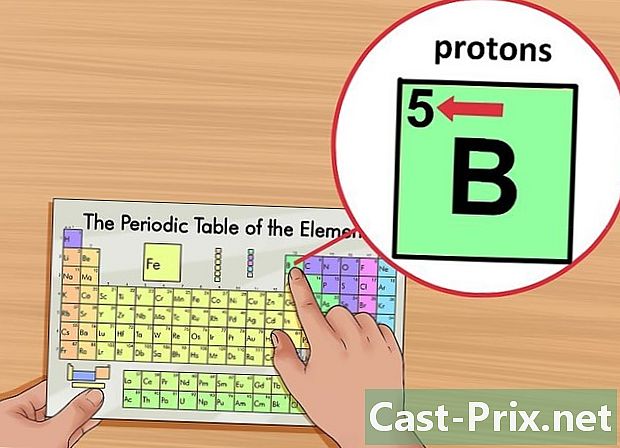
தனிமத்தின் அணு எண்ணைக் கண்டறியவும். இந்த எண் பெட்டியின் மேல் இடது மூலையில், உறுப்பு சின்னத்திற்கு மேலே குறிக்கப்பட்டுள்ளது. அணு எண் உங்களுக்கு கேள்விக்குரிய உறுப்பை உருவாக்கும் புரோட்டான்களின் எண்ணிக்கையை வழங்குகிறது.- எடுத்துக்காட்டாக, போரான் (பி) இன் அணு எண் 5. எனவே, இது 5 புரோட்டான்களைக் கொண்டுள்ளது.
-

எலக்ட்ரான்களின் எண்ணிக்கையை தீர்மானிக்கவும். ஒரு அணுவின் கருவில் நேர்மறை சார்ஜ் செய்யப்பட்ட துகள்கள் புரோட்டான்கள் உள்ளன. எலக்ட்ரான்கள் எதிர்மறையாக சார்ஜ் செய்யப்பட்ட துகள்கள். எனவே, ஒரு நடுநிலை தனிமத்தின் புரோட்டான்கள் மற்றும் எலக்ட்ரான்களின் எண்ணிக்கை ஒரே மாதிரியாக இருக்கும்.- எடுத்துக்காட்டாக, போரான் (பி) ஒரு அணு எண் 5 ஐக் கொண்டுள்ளது, எனவே இது 5 புரோட்டான்கள் மற்றும் 5 எலக்ட்ரான்களைக் கொண்டுள்ளது.
- இருப்பினும், இது நேர்மறை அல்லது எதிர்மறை அயனியாக இருந்தால், புரோட்டான்களின் எண்ணிக்கையும் எலக்ட்ரான்களின் எண்ணிக்கையும் வித்தியாசமாக இருக்கும். அவற்றை நீங்கள் கணக்கிட வேண்டும். தொடர்புடைய உருப்படிக்குப் பிறகு ஒரு அடுக்கு மூலம் சிங்கம் கட்டணம் சிறிய அச்சில் குறிக்கப்படுகிறது.
-

தனிமத்தின் அணு வெகுஜனத்தைப் பாருங்கள். இந்த படி நியூட்ரான்களின் எண்ணிக்கையைக் கண்டறிய உங்களை அனுமதிக்கும். நீங்கள் முதலில் தனிமத்தின் அணு நிறை அல்லது அணு எடையை தீர்மானிக்க வேண்டும். இந்த தரவு இந்த தனிமத்தின் அணுக்களின் சராசரி வெகுஜனத்தைக் குறிக்கிறது. இது தனிமத்தின் சின்னத்தின் கீழ் பொறிக்கப்பட்டுள்ளது.- தனிமத்தின் அணு வெகுஜனத்தை அருகிலுள்ள முழு எண்ணுக்கு வட்டமிடுவதை உறுதிப்படுத்திக் கொள்ளுங்கள். எனவே, போரான் ஒரு அணு நிறை 10.811 ஆகும், ஆனால் நீங்கள் 11 ஆக உருட்ட வேண்டும்.
-

அணு எண் மற்றும் அணு நிறை இடையே வித்தியாசத்தை உருவாக்குங்கள். நியூட்ரான்களின் எண்ணிக்கையைக் கணக்கிட, நீங்கள் அணு எண் மற்றும் அணு வெகுஜனத்தை வேறுபடுத்த வேண்டும். உங்களுக்கு ஏற்கனவே அணு எண் தெரியும் என்பதை மறந்துவிடாதீர்கள். இது புரோட்டான்களுடன் ஒத்ததாக இருக்கிறது.- போரனுக்கு, உங்களிடம்: 11 (அணு நிறை) - 5 (அணு எண்) = 6 நியூட்ரான்கள்
பகுதி 2 ஒரு அயனியில் உள்ள எலக்ட்ரான்களின் எண்ணிக்கையைக் கணக்கிடுங்கள்
-

ஒரு அயனியின் மின்சார கட்டணத்தைக் கண்டறியவும். உறுப்பு சின்னத்திற்குப் பிறகு அடுக்கு மூலம் இந்த எண் தோன்றும். அயனி என்பது எலக்ட்ரான்களைச் சேர்ப்பது அல்லது அடக்குவதால் நேர்மறை அல்லது எதிர்மறை கட்டணம் கொண்ட அணு ஆகும். ஒரு அணுவில் உள்ள புரோட்டான்களின் எண்ணிக்கை மாறுபடாது. இருப்பினும், ஒரு அயனியில், எலக்ட்ரான்களின் எண்ணிக்கை மாற்றப்படுகிறது.- ஒரு எலக்ட்ரானுக்கு எதிர்மறை கட்டணம் இருப்பதால், ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களை அகற்றிய பின் அது நேர்மறையாகிறது. மறுபுறம், எலக்ட்ரான்களைச் சேர்ப்பது கட்டணத்தை எதிர்மறையாக்கும் விளைவைக் கொண்டிருக்கும்.
- எடுத்துக்காட்டாக, N இன் சுமை -3 ஆகும். மறுபுறம், Ca இன் +2 ஆகும்.
- தனிமத்தின் சின்னம் ஒரு அடுக்குடன் பின்பற்றப்படாவிட்டால், இந்த கணக்கீடு தேவையில்லை என்பதை மறந்துவிடாதீர்கள்.
-

அணு எண்ணிலிருந்து கட்டணத்தை அகற்று. முதலில், நேர்மறை கட்டணம் கொண்ட அயனி என்பது எலக்ட்ரான்களை இழந்த ஒரு அணு ஆகும். எலக்ட்ரான்களின் எண்ணிக்கையைக் கண்டுபிடிக்க, அணு எண்ணிலிருந்து கூடுதல் கட்டணங்களைக் கழிக்க வேண்டும். சிங்கம் நேர்மறையாக இருந்தால், புரோட்டான்களின் எண்ணிக்கை எலக்ட்ரான்களை விட அதிகமாக இருக்கும்.- எடுத்துக்காட்டாக, Ca இன் கட்டணம் +2 ஆகும். இதன் விளைவாக, அவர் தனது ஆரம்ப நிலையுடன் ஒப்பிடும்போது 2 எலக்ட்ரான்களை இழந்தார். கால்சியத்தின் அணு எண் 20 க்கு சமம், எனவே சிங்கத்தில் 18 எலக்ட்ரான்கள் உள்ளன.
-

எதிர்மறை அயனிகளின் அணு எண்ணிக்கையில் ஒரு கட்டணத்தைச் சேர்க்கவும். ஒரு அயனி எதிர்மறையாக சார்ஜ் செய்யப்படும்போது, லேட்டோமில் கூடுதல் எலக்ட்ரான்கள் உள்ளன. எலக்ட்ரான்களின் மொத்த எண்ணிக்கையைக் கணக்கிட, அணு எண்ணில் கூடுதல் கட்டணங்களின் எண்ணிக்கையைச் சேர்க்க இது போதுமானது. சிங்கம் எதிர்மறையாக இருந்தால், அவனுக்கு எலக்ட்ரானை விட குறைவான புரோட்டான்கள் உள்ளன.- எடுத்துக்காட்டாக, N இன் சுமை -3 ஆகும். எனவே, அதன் ஆரம்ப நிலையுடன் ஒப்பிடும்போது மேலும் 3 எலக்ட்ரான்களைக் கொண்டுள்ளது. லாசோட்டின் அணு எண் 7. எனவே, இந்த அயனியில் 10 எலக்ட்ரான்கள் உள்ளன.

